-
생체신호 의료기술 전문기업 에이티센스(대표 정종욱)가 미국 식품의약국(FDA)으로부터 심전도 데이터 분석 소프트웨어 ‘에이티리포트(AT-Report)’에 대한 허가를 획득했다고 8일 밝혔다.
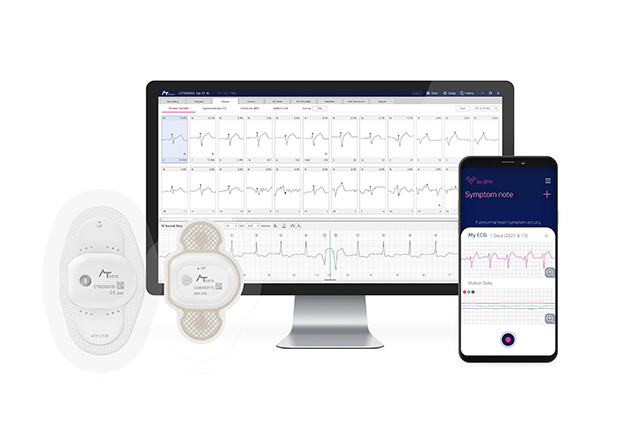
에이티리포트는 최대 14일간 연속 측정한 심전도 데이터를 분석하는 소프트웨어로, QRS 리듬(심전도 파형)을 네 가지로 분류하고 패턴에 따라 추가 분석을 수행해 높은 정밀도의 결과를 도출한다.
-
회사는 에이티리포트가 세계 1위 웨어러블 심전도 검사기기인 아이리듬 테크놀로지(iRhythm)의 지오패치(ZioPatch)와 달리 의료기관 내에서도 직접 분석이 가능해 더 높은 FDA 등급(Enhanced Level of Concern, Enhanced LOC)을 받았다고 설명했다. 아울러 이를 통해 미국 시장에서 경쟁력을 더욱 강화할 수 있을 것으로 기대했다.
에이티센스는 2022년 일회용 14일 연속 심전도 측정 기기 ‘에이티패치(AT-Patch)’의 FDA 승인을 받은 바 있다. 이번 에이티리포트의 허가로 장기 연속 심전도 측정 및 분석을 통합한 솔루션을 확보하게 된 회사는 글로벌 심전도 분석 시장에 대한 본격적인 공략에 나설 방침이다.
글로벌 심전도 기기 및 분석 소프트웨어 시장은 고령화 및 심혈관 질환 증가로 급성장하고 있다. 베리파이드 마켓 리서치에 따르면, 2023년 기준 심전도 기기 시장은 약 86억 달러, 심전도 분석 소프트웨어 시장은 15억 달러 규모로 추산된다. 각각 연평균 성장률은 7.2%와 18.5%에 이를 것으로 예상된다.
특히 미국 시장은 웨어러블 심전도 검사기기 시장에서 82.1%의 점유율을 차지하고 있다. 미국 임상 결과에 따르면, 웨어러블 심전도 검사기기의 부정맥 검출률은 24시간 검사 시 28.7%에 불과하지만, 14일 연속 측정 시 100%까지 상승하는 것으로 보고됐다.
에이티센스는 이번 FDA 허가를 계기로 하반기부터 미국 시장에 본격 진출할 계획이다. 미국 내 웨어러블 심전도 검사기기 시장은 아이리듬의 지오패치와 에이티패치가 유일한 14일 연속 측정 기기이기 때문에, 에이티리포트의 도입이 시장 내 차별화 요소가 될 것으로 기대된다.
정종욱 에이티센스 대표는 “이번 FDA 허가는 단순한 소프트웨어 승인에 그치지 않고, 에이티센스가 심전도 분석 솔루션의 글로벌 표준으로 자리 잡을 수 있는 중요한 전환점”이라며 “앞으로도 환자의 삶의 질을 높이고 의료진에게 더 나은 진단 도구를 제공하기 위해 지속적인 연구개발에 힘쓸 것”이라고 말했다.
에이티센스는 일본, 유럽, 중동 등 기존 시장에서도 에이티리포트의 판매를 확대할 계획이며, 장기적으로는 심전도 분석 소프트웨어의 AI 고도화 및 클라우드 기반 원격 모니터링 기술 개발에도 박차를 가할 방침이다.
- 김정아 기자 jungya@chosun.com