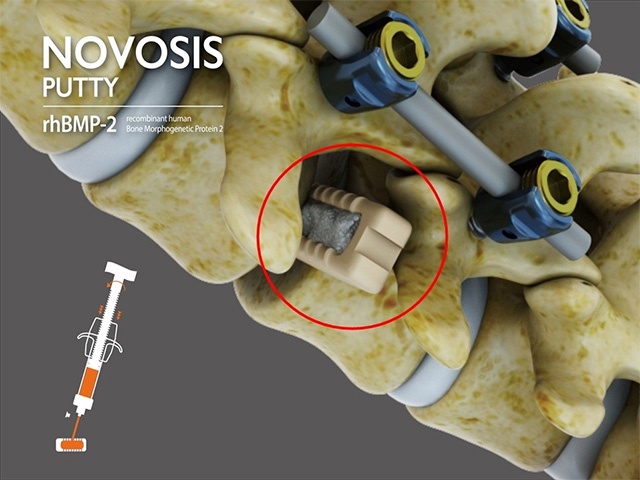
-
바이오 재생의료 전문기업 시지바이오(대표 유현승)가 미국 식품의약국(FDA)으로부터 자사의 차세대 골대체재 ‘노보시스 퍼티(NOVOSIS PUTTY)’에 대한 IDE(임상시험계획 승인, Investigational Device Exemption)를 획득했다고 21일 밝혔다.
이번 IDE 승인은 한국에서 개발된 바이오융복합 의료기기가 FDA로부터 확증임상 승인을 받은 첫 사례로, 시지바이오는 미국 시판 허가(PMA)를 위한 마지막 관문인 확증 임상(Pivotal Study)에 돌입하게 됐다.
-
‘노보시스 퍼티’는 기존 골대체재 제품인 ‘노보시스’를 기반으로 개발된 신제품으로, 골형성 단백질(rhBMP-2)과 성형 가능한 점성형 지지체를 결합한 퍼티 제형이다. 시지바이오의 서방형 제형 기술 ‘SLOREL™’이 적용돼, 뼈 생성에 기여하는 단백질의 방출 속도를 조절하면서 이상 반응을 최소화하는 것이 특징이다.
해당 제품은 2023년 12월 FDA로부터 ‘혁신의료기기(Breakthrough Device)’로 지정된 바 있다. 시지바이오는 대웅제약과의 공동 개발을 통해 rhBMP-2의 국내 생산과 품질 관리를 안정화했으며, 이번 IDE 승인 역시 양사 간 협력을 바탕으로 추진됐다.
시지바이오 측은 미국 골대체재 시장이 연간 약 1조 원 규모에 달하는 고부가가치 시장이며, 이번 IDE 승인으로 유럽과 호주 등 주요국 진입 전략에도 속도를 낼 계획이라고 밝혔다.
시지바이오 유현승 대표는 “이번 FDA IDE 승인 획득은 글로벌 시장 진입을 위한 결정적 이정표”라며 “바이오 융복합 기술을 바탕으로 미국 등 주요 시장에서 의미 있는 성과를 이어가겠다”고 말했다.
한편, 시지바이오는 일본 니혼조끼와 협력해 노보시스 퍼티의 일본 임상시험을 진행 중이며, 최근 1/2상 임상을 완료했다. 또 자회사인 시지메드텍과 함께 ‘노보시스’ 및 ‘노보시스 트라우마’ 제품을 기반으로 존슨앤드존슨 메드테크와 아시아권 독점 공급 계약을 체결한 바 있다.
- 김정아 기자 jungya@chosun.com