-
루닛이 미국 바이오헬스케어 기업 가던트헬스(Guardant Health)로부터 '클리아 인증'을 획득하고 100만 달러(한화 약 13억 원)의 기술료를 받게 됐다.
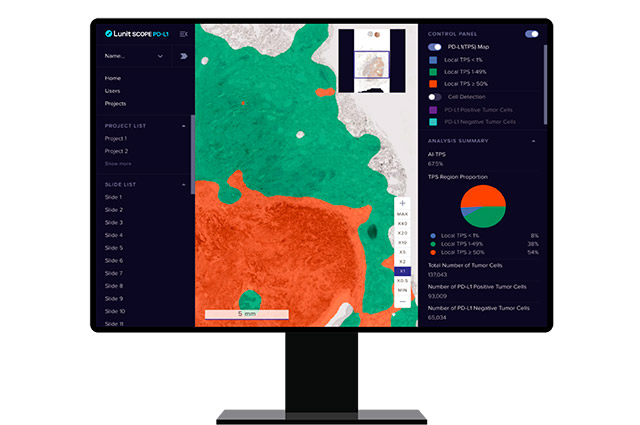
의료 인공지능(AI) 기업 루닛은 AI 병리 분석 솔루션 '루닛 스코프 PD-L1'의 미국시장 진출을 위한 클리아랩(CLIA LAB) 실험실 자체 개발 진단검사(Laboratory Developed Test, 이하 LDT)에서 유효성 검증을 완료했다고 6일 밝혔다.
-
미국 시장에 제품 및 서비스를 판매하기 위해서는 미국 실험실 표준 인증인 클리아(CLIA, Clinical Laboratory Improvement Amendments)를 획득해야 한다. 클리아(CLIA)는 미국 국가 건강보험을 운영하는 미국 보험청(Center for Medicare & Medicaid, CMS)이 검체 등의 진단에 필요한 환경 수준을 평가하는 제도이며, LDT는 클리아랩 인증 실험실에서 자체 개발한 진단 및 검사 서비스를 할 수 있도록 허용하는 제도다.
루닛은 비소세포폐암, 삼중음성유방암, 방광암으로 임상검사를 확대하기 위해 이번 LDT 유효성 검증을 성공적으로 완료함에 따라 양사 공동 연구개발 계약에 따라 기술료를 수령하게 됐다고 설명했다. 이어 올해 상반기 안에 10여 개의 암종에 대한 클리아랩 LDT 검증도 마무리 지을 계획이라고 덧붙였다.
서범석 루닛 대표는 "루닛은 가던트헬스와의 첫 공동작품이자 암 치료 분야 관련 첫 신제품을 출시한 데 이어 이번 클리아랩 LDT 검증까지 성공적으로 마무리하며 기술 경쟁력을 한 차원 끌어올렸다"며 "가던트헬스가 미국 내 대규모 유통 및 판매 채널을 확보하고 있는 만큼, 향후 본격적으로 의미 있는 성장을 이어갈 것"이라고 말했다.
한편, 루닛은 이번 LDT 검증을 진행한 가던트헬스와 협업해 루닛 스코프 PD-L1을 기반으로 한 '가던트360 티슈넥스트(Guardant360 TissueNext)'를 최근 공개했다고 밝혔다. 가던트360 티슈넥스트는 암세포 표면에 있는 단백질이자 면역항암제 치료 효과를 예측하는 바이오마커 'PD-L1(Programmed death-ligand 1)'의 발현 정도를 정확하고 객관적으로 분석하는 제품이다.
- 김정아 기자 jungya@chosun.com