-
식약처가 국내 개발 코로나19 혈장분획치료제의 2상 임상시험을 승인했다.
식품의약품안전처(이하 식약처)는 코로나19 혈장분획치료제 ‘GC5131’에 대한 2상 임상시험을 8월 20일 승인했다고 밝혔다. 임상 2상은 개발 약물을 최초로 사람에게 투여해 안전성, 약동학 등을 평가하는 단계인 1상 종료 후, 대상 환자들에게 투여해 치료 효과를 탐색하는 단계다.
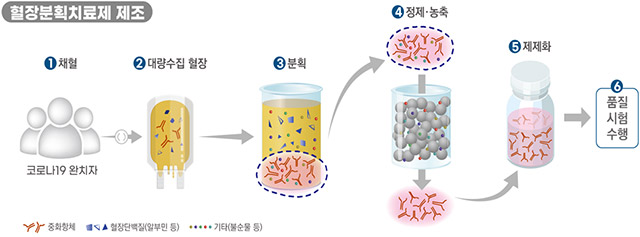
이번에 승인한 ‘GC5131’은 ‘녹십자’에서 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품으로, 코로나19 환자를 대상으로 안전성과 유효성을 평가하는 2상 임상시험을 진행하게 된다.
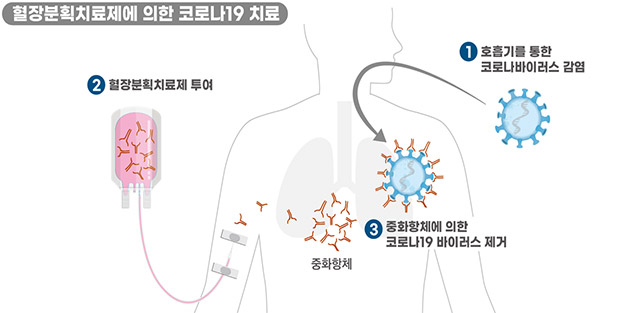
해당 제품은 코로나19 완치자의 혈액 중 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화한 것으로, 코로나19 중화항체가 농축된 면역글로불린이다.
-
식약처는 지난 3월부터 혈장분획치료제 개발을 위해 사전상담을 진행해 왔으며, 원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발되어 사용되고 있어 임상 1상 시험을 면제했다. 또한, 해외에서도 프랑스, 중국, 일본 및 이탈리아에서 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중이라고 밝혔다.
-
한편, 이번 2상 임상 승인으로 국내에서 진행 중인 코로나19 관련 치료제 및 백신 임상시험은 총 16건(치료제 14건, 백신 2건)이다.
- 김정아 기자 jungya@chosun.com
최신뉴스
Copyright ⓒ 디지틀조선일보&dizzo.com